Le Carcinome de Merkel
Traitement
Généralités
Le traitement est basé sur le stade de la maladie. Il existe 5 traitements principaux :
- exérèse chirurgicale élargie de la lésion primitive,
- le curage ganglionnaire,
- la radiothérapie externe,
- la chimiothérapie.
- l'immunothérapie
Chacun d’entre eux sera discuté plus bas. En fonction de la tolérance individuelle, ces traitements peuvent être associés ou administrés successivement.
 Tous stades confondus, une exérèse élargie de la lésion primitive doit être réalisée à chaque fois que cela est possible. Comme cela a déjà été discuté, il est important pour tous les patients sans adénopathie clinique de réaliser une biopsie exérèse du ganglion sentinelle au moment de la reprise d’exérèse, afin de détecter une micrométastase ganglionnaire. Un curage ganglionnaire de l’aire ganglionnaire de drainage peut être envisagé au stade III, avec le risque de voir survenir des effets secondaires tels qu’un lymphoedème du membre concerné. Il n’est pas certain que l’association du curage ganglionnaire avec la radiothérapie externe améliore les chances de guérison par rapport à la radiothérapie externe seule (Mortier 2003).
Tous stades confondus, une exérèse élargie de la lésion primitive doit être réalisée à chaque fois que cela est possible. Comme cela a déjà été discuté, il est important pour tous les patients sans adénopathie clinique de réaliser une biopsie exérèse du ganglion sentinelle au moment de la reprise d’exérèse, afin de détecter une micrométastase ganglionnaire. Un curage ganglionnaire de l’aire ganglionnaire de drainage peut être envisagé au stade III, avec le risque de voir survenir des effets secondaires tels qu’un lymphoedème du membre concerné. Il n’est pas certain que l’association du curage ganglionnaire avec la radiothérapie externe améliore les chances de guérison par rapport à la radiothérapie externe seule (Mortier 2003).
Nous recommandons la radiothérapie externe au niveau de la lésion initiale ainsi que sur l’aire ganglionnaire de drainage éventuellement dans les stades I II et III. La chimiothérapie doit être réservée aux patients ayant un stade IV.
Il est important d’insister sur le fait que le traitement optimal dépend de plusieurs facteurs dépendant des patients. Il est donc recommandé d’être suivi par une équipe pluridisciplinaire connaissant bien la maladie et prenant en considération un certain nombre de facteurs comme : la taille et la localisation, l’âge et les souhaits du patient, dans les prises de décisions influant sur la qualité et la durée de vie.
Exérèse chirurgicale élargie
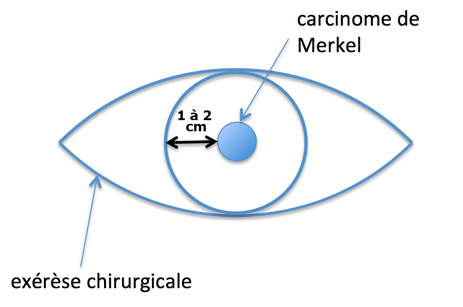
Le but est de limiter au maximum le risque de récidive loco-régionale et/ou à distance. Le CM doit être retiré avec des marges saines confirmées par l’analyse histologique. Comme c’est indiqué plus bas, même avec des marges de 1 à 2 cm, la chirurgie seule a un taux de récidive jusqu’à 42% en fonction des études. Le taux de récidive peut être divisé par 2 avec la radiothérapie externe complémentaire.
Afin d’améliorer le résultat esthétique, le chirurgien est susceptible de réaliser une exérèse en forme de fuseau. Ainsi, la longueur de la cicatrice doit être approximativement 3 fois la taille de la tumeur initiale.
En fonction de votre état général, et du siège de la tumeur initiale, la chirurgie peut être contre-indiquée. Dans cette situation, la radiothérapie externe seule peut être préconisée et aussi efficace que l’association radiothérapie-chirurgie (Mortier, 2003).
Chirurgie micrographique de Mohs
Les tumeurs cutanées développées sur la région céphalique ont un risque de récidive et de métastases plus élevé, et il est parfois impossible d’effectuer une exérèse avec les marges classiquement recommandées (1 à 2 cm). La chirurgie micrographique de Mohs peut alors être indiquée car elle permet une épargne plus importante du tissu sain. L’exérèse complète de la tumeur est évaluée en temps réel pendant l’intervention. Les données de la littérature actuelle suggèrent que la radiothérapie externe en plus de la chirurgie de Mohs optimiserait le contrôle de la maladie, en diminuant de moitié le risque de récurrence (Longo, 2003).
Radiothérapie externe et effets secondaires
| Treatment(n) | Local Recurrence | Nodal Recurrence | Distant Recurrence | Follow-up(mo) |
| Suregery only (63) | 25% | 42% | 21% | 32 |
| Suregery + Radiotherapy (37) | 3% | 22% | 11% | 23 |
| P value | .005 | .045 | 0.27 |
La radiothérapie est un traitement du cancer qui consiste en un rayonnement dont les particules sont capables de détruire les cellules cancéreuses. La zone irradiée ou champ d’irradiation comprend le site tumoral ainsi qu’une petite marge de tissu normal adjacent. Les rayons endommagent le matériel génétique de la cellule cancéreuse empêchant ainsi la croissance tumorale, mais aussi celle des cellules du tissu sain. La radiothérapie adjuvante est utilisée pour détruire les cellules tumorales résiduelles non cliniquement décelables après l’exérèse chirurgicale.
Nous recommandons de faire de la radiothérapie sur le lit tumoral ainsi que sur l’aire ganglionnaire de drainage éventuellement. Cette recommandation est basée sur un certain nombre d’études montrant une amélioration du contrôle de la maladie avec la radiothérapie (Longo, 2003).
Notre analyse de la littérature ainsi que notre expérience montrent une amélioration significative du taux de récidive locale et régionale mais pas de la survie. Quand l’exérèse élargie n’est pas possible, une étude récente suggère que la radiothérapie seule peut être aussi efficace que l’association chirurgie-radiothérapie. Ces données suggèrent un rôle important de la radiothérapie sur le lit tumoral et l’aire ganglionnaire de drainage pour les stades I, II et III. La dose délivrée est mesurée en Gray (Gy). La dose totale délivrée doit être supérieure ou égale à 50 Gy. La dose totale est fractionnée en séances de 10-15 minutes 5 jours par semaine sur 5 semaines habituellement.
Effets secondaires possibles
Les effets secondaires sur le territoire irradié sont : la chute de cheveux, l’irritation avec effet coup de soleil, une modification de la couleur et/ou de la texture de la peau. L’irradiation des aires ganglionnaires peut être responsable d’un oedème du membre homo-latéral pouvant durer longtemps dans certains cas exceptionnels. Un effet secondaire fréquent est la fatigue mais il s’estompe rapidement après l’arrêt du traitement. Il est donc recommandé d’avoir une alimentation équilibrée et de se reposer. Le radiothérapeute est susceptible d’adapter le schéma thérapeutique en fonction des effets secondaires pour chaque patient.
Chimiothérapie
 La chimiothérapie est un traitement qui détruit les cellules cancéreuses. Ce traitement a pour cible les cellules qui se divisent rapidement, incluant les cellules cancéreuses qui se multiplient de façon incontrôlée et certaines cellules saines qui se divisent rapidement.
La chimiothérapie est un traitement qui détruit les cellules cancéreuses. Ce traitement a pour cible les cellules qui se divisent rapidement, incluant les cellules cancéreuses qui se multiplient de façon incontrôlée et certaines cellules saines qui se divisent rapidement.
La chimiothérapie adjuvante est utilisée en complément de la chirurgie et/ou de la radiothérapie afin de détruire les cellules tumorales potentiellement résiduelles. La chimiothérapie peut être administrée par voie orale ou intra-veineuse de façon séquentielle certains jours de la semaine pendant plusieurs semaines.
La polychimiothérapie correspond à l’utilisation de plusieurs drogues dont l’association simultanée est synergique améliorant ainsi leur efficacité. Il n’y a pas d’association thérapeutique pré-définie concernant le CM.
Cette tumeur a des similitudes avec les autres carcinomes neuroendocrines comme le cancer du poumon à petites cellules. Pour cette raison votre médecin est susceptible d’utiliser des drogues efficaces dans ce type de cancer. L’association Etoposide-carboplatine en est un exemple. Les données concernant ce traitement proviennent d’une étude de 53 patients ayant montré une survie à 3 ans de 76% des patients traités par l’association radiothérapie-chimiothérapie (Poulsen, 2003). Cependant cette étude ne permettait pas de déterminer si la chimiothérapie adjuvante améliorait le pronostic, parce que, d’une part la survie n’était globalement pas modifiée par rapport à ce qui était attendu, et parce que l’étude n’était pas aléatoire.
6 raisons pour lesquelles nous ne recommandons pas habituellement la chimiothérapie adjuvante :
(La chimiothérapie adjuvante est utilisée pour détruire les cellules cancéreuses résiduelles après chirurgie et/ou radiothérapie)- La mortalité : 4 à 7 % des décès sont dus à la chimiothérapie dans le CM probablement parce que les patients sont souvent très âgés (Voog 1999; Tai 2000).
- La morbidité : neutropénie : (diminution du nombre de globules blancs) survenant dans 60% des cas avec fièvre et sepsis dans 40% des cas (Poulson 2001).
- Diminution de la qualité de vie qui peut être très sévère dans les populations âgées, incluant fatigue, chute de cheveux nausées et vomissements.
- Résistance à la chimiothérapie : Un CM récidivant après chimiothérapie répond moins bien à une chimiothérapie ultérieure.
- Immunité : la chimiothérapie entraîne une immunodépression alors que la qualité de la réponse immunitaire apparaît très importante dans le contrôle et la prévention du CM.
- Pronostic apparemment moins bon : parmi les patients ayant une extension ganglionnaire il y avait un taux de survie de 60% chez 53 patients n’ayant pas reçu de chimiothérapie, alors que le taux de survie était de 40% chez ceux recevant une chimiothérapie adjuvante (Allen 2005). Bien qu’il ne s’agisse pas d’un essai aléatoire et que la différence ne soit pas significative, ces constatations suggèrent qu’il n’y a pas de bénéfice sur la survie avec la chimiothérapie adjuvante.
A l’inverse de la situation adjuvante, la chimiothérapie semble apporter un certain bénéfice pour le carcinome de Merkel inopérable ou métastatique. Plusieurs publications ont en effet montré une réponse favorable initiale chez plus de la moitié des patients au stade IV. Malheureusement, une perte d’efficacité de la chimiothérapie est très souvent observée à plus ou moins long terme.
Immunothérapie
L’immunothérapie est un traitement qui améliore la capacité du système immunitaire du patient à reconnaître et détruire les cellules cancéreuses dans le corps. Les « checkpoint inhibitors » sont les médicaments d’immunothérapie les plus utilisés actuellement. Ils agissent en bloquant des molécules à la surface des cellules du système immunitaire, PD1 ou PDL1, dont l’interaction est un « frein » à la réponse immunitaire.
Ces checkpoint inhibitors s’administrent par voie intra-veineuse et ont déjà montré leur efficacité dans de nombreux autres types de cancer (mélanome, cancer du poumon, etc), entraînant des réponses qui sont souvent prolongées.
Dans le carcinome de Merkel, 2 essais cliniques d’immunothérapie par checkpoint inhibitors ont été publiés récemment, avec des résultats très prometteurs (Avelumab et Pembrolizumab). Le premier a évalué un anti-PDL1, l’avelumab, chez 88 patients en stade IV ayant échappé à la chimiothérapie : 33% des patients présentaient une réponse partielle ou complète. La 2ème étude a évalué un anti-PD1, le pembrolizumab, en 1ère ligne dans 26 cas de carcinomes de Merkel inopérables ou métastatiques : le taux de réponse était de 56%. Qui plus est, pour les 2 médicaments, l’efficacité était maintenue de façon prolongée dans le temps chez la majorité des patients répondeurs.
Ces résultats très encourageants ont permis à l’avelumab d’obtenir l’Autorisation de Mise sur le Marché en septembre 2017. Son inscription sur la liste des produits pris en charge par les établissements hospitaliers est actuellement en attente.
Surveillance
Le CM est pris en charge de façon optimale par une équipe médicale regroupant des dermatologues-oncologues, des chirurgiens, et des radiothérapeutes. La plupart des récidives ou des décès survient dans les 3 ans. Les patients doivent avoir des consultations régulières tous les 3 à 6 mois pendant les 3 premières années. Dans certains cas (les plus à risque) un scanner est réalisé tous les 6 mois pendant plusieurs années.
S’il n’y a pas eu de récidive ou de métastases pendant les 3 premières années il est alors possible d’espacer la surveillance. Quoi qu’il en soit, n’hésitez pas à consulter votre médecin pour toute lésion suspecte ou autre symptôme.
